Quelato
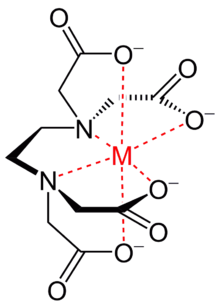
Complexo metal-EDTA.
Quelato é um composto químico formado por um íon metálico ligado por várias ligações covalentes a um agente quelante, uma estrutura heterocíclica de compostos orgânicos como aminoácidos, peptídeos ou polissacarídeos.
O nome quelante provém da palavra grega chele, que significa garra ou pinça, referindo-se à forma pela qual os íons metálicos são “aprisionados” no composto.
Índice
1 História
2 Importância e usos
3 Exemplo: Formação de um complexo cis-platina (II) com etilenodiamina
4 Referências
5 Ligações externas
6 Ver também
História |
O termo quelato foi primeiramente usado em 1920 por Sir Gilbert T. Morgan e H. D. K. Drew, que escreveram:
| “ | Propomos o adjetivo "chelant", derivado do grego chele (grande garra da lagosta ou outros crustáceos), para descrever os grupos em "braços de pinça" ("caliperlike") que funcionam como duas unidades associadas entre si e se fixam ao átomo central de modo a produzirem anéis heterocíclicos.[1] | ” |
Importância e usos |
Alguns quelatos são compostos extremamente importantes para a vida na terra, como a hemoglobina, um quelato de ferro responsável pelo transporte de oxigênio e gás carbônico no sangue; e a clorofila, quelato de magnésio responsável pela absorção dos fótons da luz solar pelas plantas verdes.
Na medicina, os quelatos têm diversas aplicações ligadas à medicina moderna. No tratamento de envenenamentos metálicos por chumbo, mercúrio ou outros elementos pesados, por exemplo, agentes quelantes são administrados para “sequestrar” os íons metálicos, formando compostos quelatos que possibilitam sua eliminação pelo organismo, num tratamento às vezes denominado quelação.[2] Já no processo exatamente oposto, elementos metálicos quelatados (ou quelados) são administrados para corrigir deficiências minerais em seres humanos ou animais, por possibilitar a melhor absorção dos íons metálicos no trato intestinal.[3] A quimioterapia contra o câncer pode utilizar selênio quelatado, por exemplo.[4]
Na química, agentes quelantes podem ser utilizados para remover íons metálicos em soluções. O EDTA, ácido etilenodiaminotetracético, coordena-se através de até 6 pontos doadores de um metal, preferencialmente em geometria octaédrica. Os sais de EDTA se empregam amplamente nos detergentes para formar complexos com o cálcio ou em medicina, em casos de intoxicação. A etilenodiamina, outro importante agente quelante, coordena-se a metais através dos pares de elétrons livres nos dois átomos de nitrogênio em sua estrutura, formando, normalmente, compostos quirais de geometria octaédrica de fórmula geral M(en)3n+, dos quais se podem separar os enantiômeros.
O DPPE, também chamado 1,2-bis(difenilfosfino)etileno, coordena através de pares livres de elétrons dos dois átomos de fósforo, e derivados deste composto se empregam em alguns catalisadores.[5] O oxalato é outro quelante muito usado, alvo de estudos em razão de grande parte dos cálculos renais serem formados por estruturas que contém esse sal.[6] Em síntese orgânica, têm adquirido um interesse especial os ligantes quelatantes quirais, já que se empregam diretamente nos catalisadores empregados para obter produtos quirais, como o catalisador de Wilkinson.
Na atualidade, existem milhares de ligantes quelantes tanto sintéticos como naturais conhecidos.
Exemplo: Formação de um complexo cis-platina (II) com etilenodiamina |
Referências
↑ Morgan, Gilbert T.; Drew, Harry Dugald Keith (1920). "CLXII.—Researches on residual affinity and co-ordination. Part II. Acetylacetones of selenium and tellurium". Journal of the Chemical Society, Transactions. 117: 1456–65. doi:10.1039/ct9201701456
↑ Florence, A. T. (2003). Princípios físico-químicos em farmácia 3ª ed. São Paulo: edUSP. pp. 602–606|acessodata=requer|url=(ajuda)
↑ Oliveira, Rafael Carvalho de (2008). «Morfometria computacional de órgãos de frangos de corte submetidos a duas dietas distintas: suplementação mineral quelada versus suplementação mineral tradicional». doi:10.11606/T.95.2008.tde-06102009-102826. Consultado em 3 de dezembro de 2016
↑ «Informativo técnico - Metais Quelatos(Selênio)» (PDF). PharmaNostra. 9 de julho de 2012. Consultado em 3 de dezembro de 2016. Arquivado do original (PDF) em 21 de Dezembro de 2016
↑ «Estudo de monocamadas fosfolipidicas nanoestruturadas obtidas por LB para aplicações em biossensores». www.bibliotecadigital.ufmg.br. Consultado em 3 de dezembro de 2016
↑ N., COSTA, F. (30 de setembro de 2008). «Estudos sobre o oxalato de cálcio dihidratado encontrado em pedras de rins»
Ligações externas |
Quelatos em agricultura (em castelhano)
Ver também |
- EDTA
- Titulação de complexação